La radiothérapie a vu le jour à la fin du 19e siècle, mais elle n’en demeure pas moins novatrice et compte toujours parmi les traitements les plus prescrits contre la plupart des formes de cancer. Il n’existe aujourd’hui pas une, mais des radiothérapies qui s’adaptent aux types de tumeurs, à leurs localisations et à leurs tailles. La recherche a permis de gagner en précision et en efficacité, améliorant de fait la réponse au traitement, la sécurité et la qualité de vie du patient.
Tour d’horizon des innovations qui font de la radiothérapie un incontournable outil de la lutte contre le cancer.
 Téléchargez le magazine complet en .pdf
Téléchargez le magazine complet en .pdf
La radiothérapie est une technique de traitement locorégional des cancers, qui utilise des rayonnements permettant de détruire les cellules cancéreuses. 60% des patients atteints de cancer en France sont orientés vers des traitements par radiothérapie, ce qui représente près de 180 000 patients par an. La radiothérapie leur met à disposition un important arsenal de solutions. Elle est dite soit externe lorsque le rayonnement est produit à partir d’une source extérieure, soit interne si la source se trouve au sein de la tumeur, ce qui est par exemple le cas de la Curiethérapie. La radiothérapie peut être utilisée comme un outil curatif exclusif ou combiné à d’autres thérapies telles que la chirurgie ou la chimiothérapie. C’est aussi devenu un outil prohylactique (c’est-à-dire préventif), permettant de devancer l’apparition de métastases. Enfin, la radiothérapie peut également être palliative, permettant alors de diminuer une douleur ou un saignement.
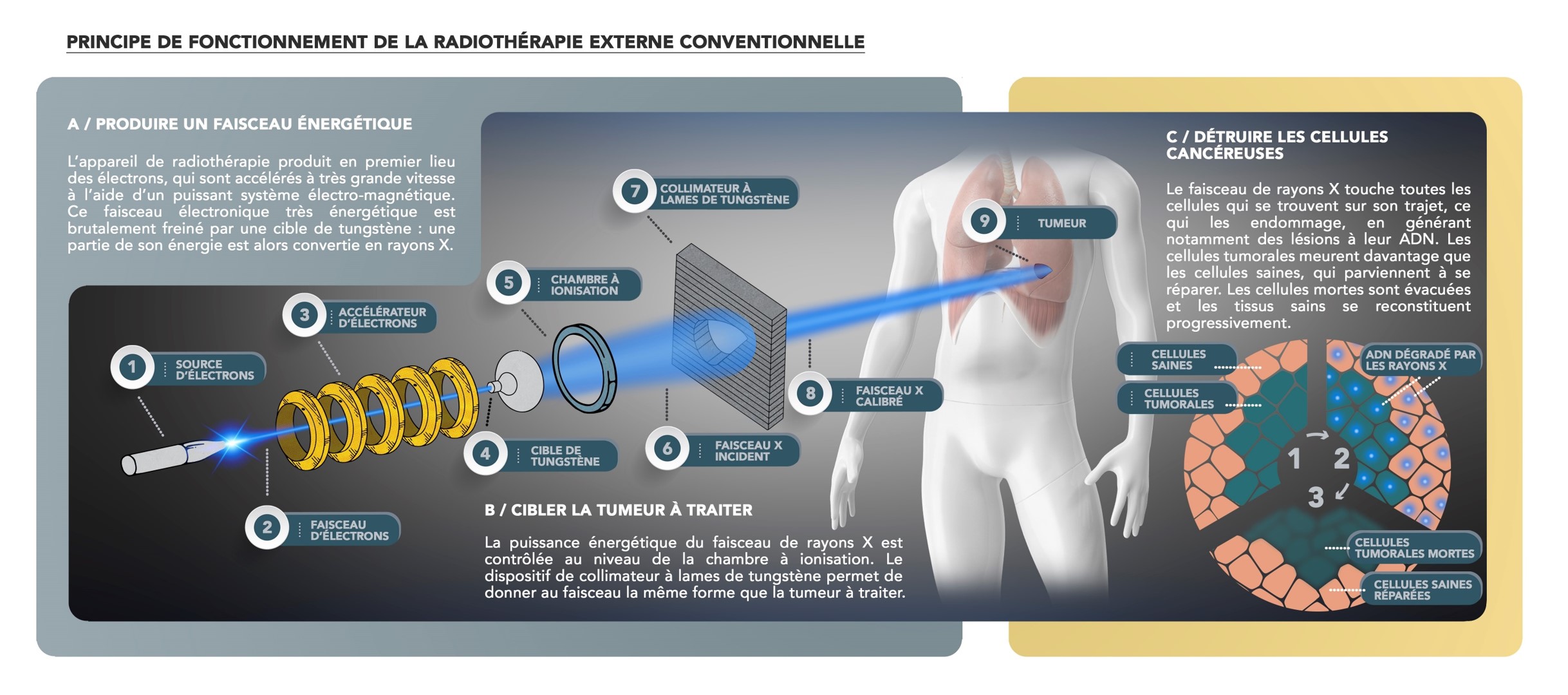
Le principe de la radiothérapie est assez simple. La première étape consiste en la production d’un rayonnement ionisant énergétique. En radiothérapie conventionnelle, des électrons sont envoyés à très grande vitesse sur des atomes, grâce à un accélérateur. De ces collisions résulteront des rayons X (appelés aussi des photons) qui seront ensuite focalisés sur la tumeur à traiter, c’est le ciblage. L’objectif de cette étape consiste à préserver le tissu sain environnant et à délivrer une dose maximale au cœur de la tumeur. Ensuite se déclenche la phase de destruction cellulaire. Les rayons agiront soit directement sur les macromolécules présentes dans les cellules (protéines, ADN, …), soit indirectement via l’apparition d’espèces chimiques assez agressives, les radicaux libres.
Le risque existe que des cellules saines, situées sur le chemin des rayons, soient atteintes par les faisceaux. Cependant, les cellules cancéreuses sont plus sensibles aux radiations que les cellules saines dont les mécanismes de récupération et de réparation (par exemple de l’ADN) sont plus performants, elles prennent ainsi le temps, entre chaque séance de radiothérapie, de « se refaire une jeunesse ». Cette capacité de réparation, combinée à l’amélioration des techniques de ciblage, font de la radiothérapie un traitement minimisant les effets secondaires néfastes.
Dans les laboratoires de biologie, de physique ou d’ingénierie, la recherche avance, améliore la radiothérapie conventionnelle et développe d’autres techniques innovantes.
Certaines cellules cancéreuses demeurent très résistantes et des travaux de recherche et de développements pluridisciplinaires sont nécessaires pour augmenter le potentiel de la radiothérapie. L’objectif de ces nouvelles radiothérapies : cibler la tumeur avec une dose la plus efficace possible tout en limitant l’irradiation des organes sains à proximité. C’est ainsi que des laboratoires régionaux de biophysique s’intéressent à trois radiothérapies innovantes : l’HADRONTHÉRAPIE, la RADIOTHÉRAPIE FLASH et la combinaison de NANOPARTICULES avec le rayonnement.
L’hadronthérapie : pour une balistique plus précise et une efficacité accrue
La radiothérapie conventionnelle utilise les rayons X. Parmi les dernières innovations, certaines d’entre-elles utilisent l’avantage balistique d’un faisceau de particules tel que les protons ou les ions carbones, c’est l’exemple de l’HADRONTHÉRAPIE. Cette technique permet d’atteindre plus précisément la cible tout en épargnant les tissus sains environnants. En effet les hadrons (protons, carbone) acquièrent de l’énergie dans les accélérateurs de particules et sont guidés en faisceaux sur la tumeur tout en libérant relativement peu d’énergie sur leur passage. En revanche, ces faisceaux déposent un maximum d’énergie en fin de course dans la cible (ce qu’on appelle le pic de Bragg[1]). On peut ajuster la profondeur de ce pic de Bragg en ajustant l’énergie du faisceau. C’est donc une thérapie prometteuse pour les tumeurs localisées en profondeur, souvent non opérables ou résistantes aux rayons X.
La contrepartie de la précision est un délicat contrôle de la trajectoire du « tir », pour éviter toute déviation ou pallier aux mouvements du patient. Afin de remédier à cette problématique, des chercheurs de Lyon et Grenoble[2] réfléchissent (au sein d’une collaboration nationale) à l’utilisation en direct d’un détecteur de rayons gamma[3]. L’idée finale serait que, au cours d’un traitement, une caméra gamma mesure la position du faisceau et du pic de Bragg dans le patient pour rectifier en direct, par ajustement simultané du faisceau, les petites déviations détectées.
La radiothérapie FLASH : la rapidité
La RADIOTHÉRAPIE FLASH est une innovation basée sur la rapidité du traitement par les rayons. Grâce à l’utilisation d’un accélérateur de particules nommé synchrotron, les radiations atteignent leur cible, la tumeur, très brièvement (pendant quelques millisecondes) mais à haute dose. Il a été constaté que la brièveté de l’irradiation permet aux tissus sains de mieux réparer les dommages induits que les tissus tumoraux, pour une raison à ce jour encore inconnue.
Cet effet différentiel entre tissus sains et tumoraux permet donc de diminuer le nombre de séances (le fractionnement des séances est nécessaire pour permettre la reconstruction des tissus sains). De plus, la rapidité de l’irradiation permet de s’affranchir du mouvement du patient, un aspect non négligeable en radiothérapie conventionnelle. Les premières tumeurs analysées en radiothérapie FLASH en 2014 ont permis de se rendre compte que la recherche tenait là une technologie fiable et faisable.
Associées à cette radiothérapie FLASH et afin de permettre un ciblage encore plus précis, les équipes de physiciens de la région développent des « peignes » d’irradiation avec le rayonnement synchrotron de l’ESRF[4], produisant ainsi des MICROFAISCEAUX qui se croisent au niveau de la tumeur. Cette dernière est alors irradiée avec un débit de dose supérieur, au carrefour des différents faisceaux.
Sur Grenoble, l’équipe de Denis Dauvergne[5] travaille sur des détecteurs « diamant ». Grâce aux propriétés électroniques de ce cristal de carbone, ces détecteurs ont la spécificité d’être très rapides, d’absorber des doses d’énergie assez conséquentes avec une grande dynamique. Ces propriétés permettront de contrôler en direct l’irradiation des patients lors de l’utilisation des microfaisceaux, avec des pics de très haute énergie et des vallées d’énergie pratiquement nulle. Ils pourront aussi s’adapter à d’autres types de rayonnements ionisants tels que ceux de l’hadronthérapie.
L’utilisation des nanoparticules : petit mais costaud
Les NANOPARTICULES commencent à pousser les portes de la phase clinique. Leur mission : démultiplier l’effet du rayonnement dans la tumeur. Le principe est simple, le patient se voit injecter au cœur de la tumeur des particules infiniment petites qui, par leur composition, ont un pouvoir d’interaction avec les rayons beaucoup plus élevé qu’avec l’eau. L’efficacité de destruction est ainsi fortement amplifiée au cœur de la tumeur, sans pour autant toucher aux tissus sains qui ne reçoivent pas ou moins de nanoparticules.
Des essais cliniques avec les nanoparticules sont en cours de déploiement. Le Dr Camille Verry a coordonné un essai chez l’Homme, consistant à analyser la toxicité du traitement sur les patients. Les résultats de cette phase 1 ont pu montrer une absence d’effets secondaires chez les patients et une accumulation des nanoparticules dans la tumeur. Les résultats obtenus étant favorables, un essai multicentrique (15 centres hospitaliers) de phase 2 est désormais en cours, pour analyser l’efficacité de ce nouveau traitement combiné à la radiothérapie conventionnelle. Ces nouvelles modalités de traitement soulèvent de nombreuses questions : où vont se fixer les nanoparticules ? Vont-elles se coller à l’ADN ? Vont-elles circuler à l’extérieur de la tumeur ? À quel moment irradier la tumeur ? Autant de paramètres importants à évaluer si l’on veut atteindre une efficacité optimale de la technique.
Cet article n’a pas pour vocation d’être exhaustif sur l’ensemble des innovations en radiothérapies en cours d’étude à Grenoble et Lyon. D’autres pistes de recherche existent, telle que la PDTX, la thérapie photo dynamique, ou encore la BNCT, la thérapie par capture de neutrons par des noyaux d’atomes de bore.
La radiobiologie, l’outil indispensable
L’arsenal des radiothérapies s’étend, les types tumoraux également. Toutes ces innovations en radiothérapie, qui arrivent en clinique, se développent de concert avec la biologie afin de pouvoir étudier les effets des rayonnements, notamment des rayonnements ionisants, sur les êtres vivants.
La radiobiologie a vu elle aussi le jour il y a plus d’un siècle, en parallèle de la radiothérapie. Les avancées de la recherche permettent aujourd’hui de mieux comprendre l’effet des différents rayonnements au niveau cellulaire et particulièrement sur leur ADN, visant à démontrer pourquoi la cellule tumorale est plus sensible à un type de rayonnement plutôt qu’à un autre. L’équipe PRISME de Michaël Beuve et Claire Rodriguez-Lafrasse, à l’Institut de Physique des 2 Infinis, s’est spécialisée dans l’étude de la radiorésistance des tumeurs. Composée de biologistes et de physiciens, elle vise notamment à développer un modèle permettant de faire le pont entre les processus physiques des radiations et la réponse des cellules. Cela permet alors de développer des logiciels de SIMULATIONS NUMÉRIQUES de la dose dite biologique afin de prédire la réponse de la tumeur à la radiothérapie.
L’équipe analyse aussi les identifiants biologiques, les BIOMARQUEURS, qui pourraient permettre à l’avenir de prédire la réponse des patients aux radiothérapies. En effet, ces biomarqueurs permettraient de déterminer avant les séances, le caractère radiosensible ou résistant de la tumeur du patient. Le médecin pourrait ainsi orienter le patient vers la radiothérapie la plus efficace et la moins toxique pour lui. À l’avenir, l’intégration de ces données dans les modèles biophysiques permettront d’optimiser la planification des traitements.
Notes :
[1] Le pic de Bragg (découvert par William Henry Bragg en 1903) représente le pic de radiations dans la matière, avant que cette énergie ne se dissipe de manière conséquente.
[2] CNRS, Université Claude Bernard Lyon 1, Université Grenoble Alpes, Insa Lyon
[3] Rayon gamma : les rayons gamma sont les rayons émis suite à la collision entre le faisceau d’ions et les noyaux des atomes le long du parcours. L’émission de rayons gamma est corrélée au dépôt de dose, cela signifie qu’on peut réaliser une imagerie du parcours des ions dans le patient – et en particulier du fameux pic de Bragg – grâce à une caméra gamma.
[4] Installation Européenne de Rayonnement Synchrotron, située à Grenoble (esrf.eu)
[5] Denis Dauvergne : Directeur de recherche – chef du groupe « Physique Nucléaire et Applications Médicales » du Laboratoire de Physique Subatomique et de Cosmologie de l’Université Grenoble Alpes et du CNRS